Bio-Share 工艺表征 | 工艺表征中CPP识别的进阶方法——实际显著性的应用
发布时间: Nov 08 , 2022
FDA在2004年《Pharmaceutical cGMP for the 21st century-A Risk Based Approach》报告中正式提出QbD的概念,并被ICH纳入质量体系中。
QbD以预先设定的目标产品质量特性作为研发的起点,在了解关键质量属性(CQA, Critical Quality Attribute)的基础上,通过实验设计的方法,识别出影响产品CQA的关键工艺参数(CPP, Critical Process Parameters),并建立相应参数的设计空间。从而建立质量风险管理,确立质量控制策略和药品质量体系。
作为行业标杆,Roche/Genentech公司对于QbD理念的实施已经形成完整的体系,从工艺参数和产品属性两个维度,建立起了药品全生命周期的控制策略。
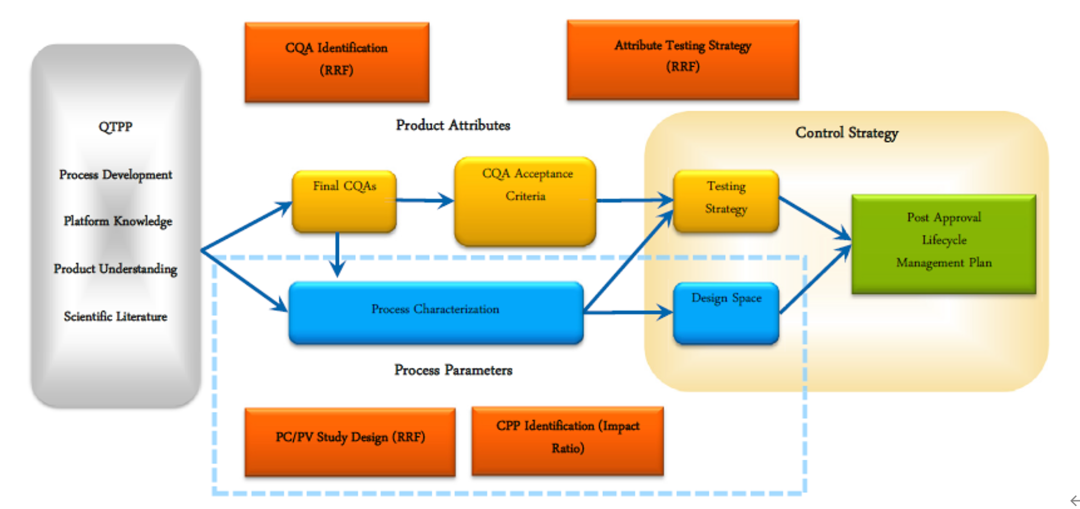
Fig.1 Quality by Design risk assessment tools provide a consistent and coordinated decision-making framework [1]
工艺表征(PC, Process Characterization)作为实施QbD理念中的重要一环,其中最重要的步骤就是筛选出合适的CPP,并确定其范围。一般来说,CPP的识别及范围确定包括以下几步:
1. 通过PC前的风险评估,识别出所有可能影响产品质量的高风险工艺参数;
2. 确定这些高风险工艺参数的初步范围;
3. 计划并执行一项表征研究,以调查这些初步范围内的高风险工艺参数;
4. 利用表征实验的结果来确定CPP及其范围。
短短4句话看起来轻描淡写,具体实施起来隐藏了海量的细节问题值得去探讨去解决。那在一般情况下,CPP的识别是采用什么方法呢?这首先就不得不提到实验设计(DoE, Design of Experiment)了。在工艺表征实验中,为了进行多个变量的研究,一般会选择DoE的方式进行实验。
在实验结束后,我们会对数据进行分析,当某工艺参数的变化对CQA影响的p值<0.05时,就认为这一参数具有统计显著性。p<0.05这一统计显著性的标准,虽然受到越来越多的质疑,但仍然是科研领域最常用的标准。
然而,参数对于CQA的影响具有统计显著性,是否就可以认为这个参数是CPP呢?一般来说是可以的,但是深入考虑一下,其实并没有那么合理,会导致一些对于CQA有影响但变异性不大的参数被识别为CPP,不合理地增加了CPP的数量,加大了后续工艺控制的难度。
追根溯源来看,我们控制抗体质量的初衷是什么呢?并不是机械地将某一项质量控制在一个极小的范围内不准有波动,而是要保证药品的安全性和有效性。正是考虑到这点,很多国际大厂都引入了实际显著性这一理念,通过实际显著性这一结合DoE数据分析及CQA实际情况两个维度而得到的概念,对于参数的关键性进行评估,从而更加合理地进行CPP的识别工作。从下图的统计中可以看到,在CPP识别过程中,只采用统计显著性的公司占比仅仅为9%。
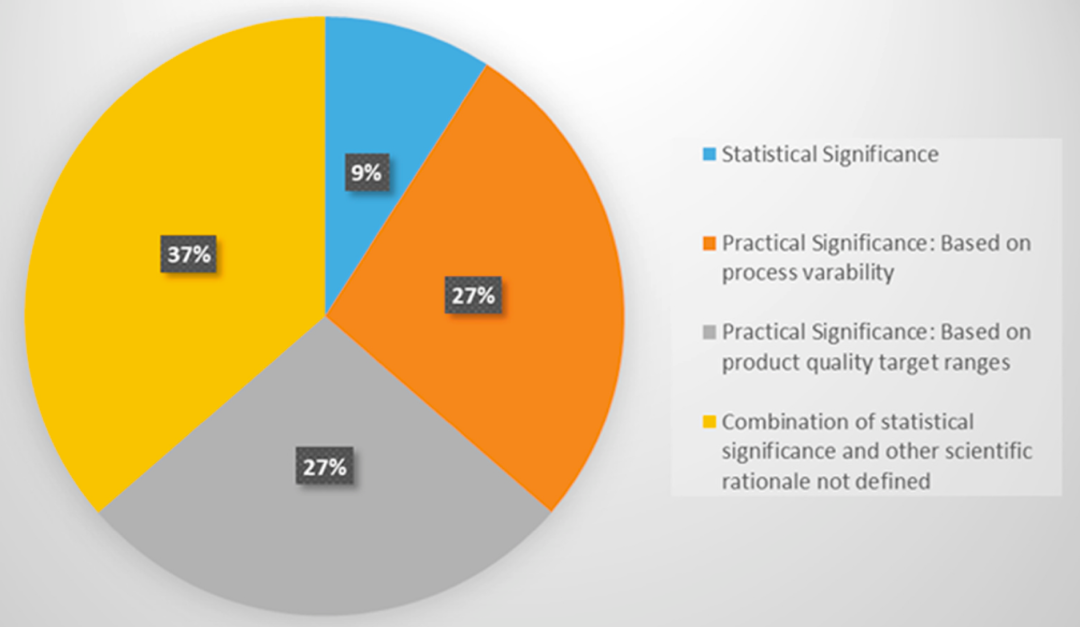
Fig.2 Summary of industry approaches to CPP identification [2]
既然实际显著性这么有用,那又有很多问题被摆了出来,究竟要怎么去理解并通过可量化的数字形式来表达出这个有些抽象的“实际”概念呢?很多国际大公司无私地给出了他们自己的见解和实践案例,下面让我们选出其中三个公司的案例进行分析。
01 The First Case案例一
首先来看QbD理念实践的先驱Roche/Genentech公司,他们在工艺表征的过程中,对于实际显著性的应用已经不局限于CPP的识别工作中,在缩小模型的确认方面也采用了实际显著性的范围来进行等价性检验。
在2016年发表的文献中,Roche/Genentech采用实际显著差异的理念(PSD, practically significant difference)对CPP进行识别,而表征PSD的参数为影响系数(IR, Impact Ratio),IR的具体计算公式如下。
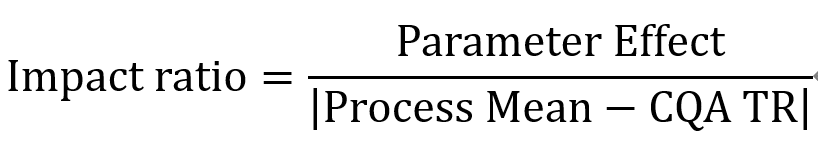
其中Parameter Effect是参数的变化(从可接受范围的中点变到极值)对于CQA变化的影响,在DoE实验的数据分析中可以得到;Process Mean为参数设定为目标值进行生产时的CQA平均值;CQA-TR是CQA目标范围中距离Process Mean距离较近的那一边。CQA-TR这一概念又是Roche/Genentech公司在工艺表征过程中一个很重要的概念,篇幅原因这里先按下不表。
按照公式进行计算,当IR值>0.33时,认为该参数为高影响的CPP;当0.33≥IR值≥0.10时,认为该参数为低影响CPP;当IR值<0.10时,认为该参数不是CPP。从原理上来看,IR就是在比较工艺参数对CQA的影响和生产中实际CQA数值到可接受范围距离,如果这个比例为0.1就说明十个这种影响的参数同时从中间值漂移到极值时,才会使CQA超出可接受范围,这显然是不可能发生的情况。下图是Impact Ratio概念的原理图。

Fig.3 Illustration of impact ratio calculation [1]
虽然IR这一概念的应用已经非常先进,但仔细考虑的话会发现,文章中IR的使用仍然在细节上存在一些不明确的地方,例如没有描述存在交互作用和平方项时IR值的计算方法、参数变化考虑的是中点到极值没有说明目标值不在中点时的计算方法等等。因此,精益求精的Roche/Genentech公司在2022年针对刚刚提到的这些问题,在研究中进一步完善了他们对于IR定义,新的定义更加细化、严谨和标准化,使IR的使用更加有规范性。
由于通篇文章的描述非常严谨,对于所有的计算公式预设了一定的前提条件,而且是通过纯数字的方式来表达所有的回归模型和计算,所以其阅读起来有一定难度。但通读全文后大家会发现,其本质原理同之前IR的计算方式是一致的。
由于篇幅所限,这里就针对前一篇文献中没有提到的交互作用的IR值计算进行讲解。不同于单因素的IR值计算,两个参数交互作用的参数设置方式变成了四种组合,分别是(低,低)、(低,高)、(高,低)和(高,高),用数字形式表示的话,分别为ei-j-, ei-j+, ei+j-, ei+j+,其中ei-j-= (t1,...,ti-1, -1, ti+1,...,tj-1, -1 ,tj+1,...,tp),代表p个参数(p个维度)下第i和j个参数取值为-1,其余参数取值为目标值。据此,IR值中分子的计算如下所示,分别为:

而交互作用IR值的计算如下,其中CQA仅有上限可接受范围的采用IR2U,仅有下限的采用IR2L,上下限都有的选用IR2:
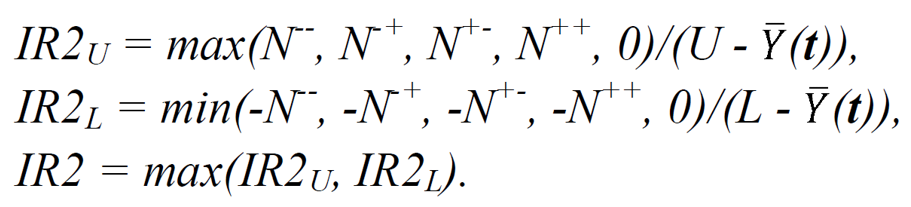
在最终识别CPP时,将两个参数(X1, X2)交互作用计算得到的IR2减去另一个参数(X2)计算得到的IR值,当差值大于30%时,即认为该参数(X1)为CPP。具体的案例如下图所示,其中X3和X4的交互作用IR2U=80%,同时X3的IRU=64%,X4的IRU=12%,通过计算发现,在交互作用IR值的计算(80% - 12%=68% > 30%)当中,可认为X3为CPP。
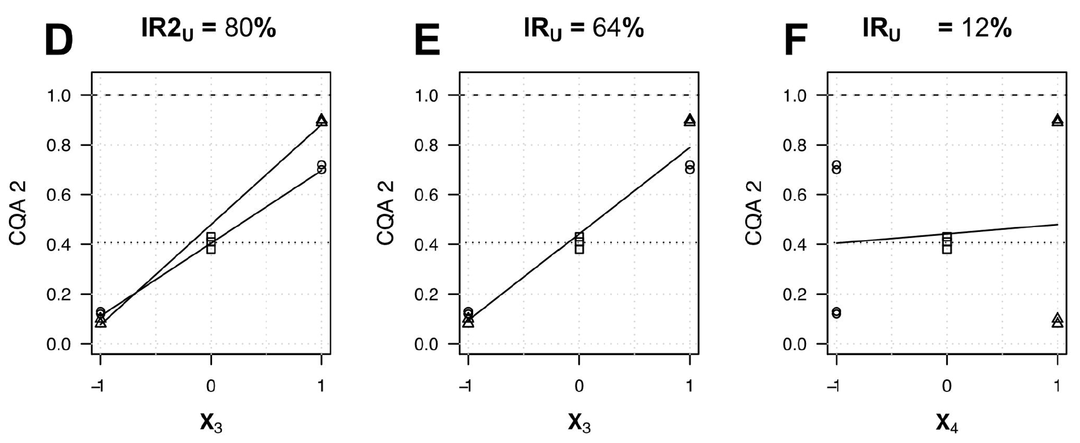
Fig.4 Impact ratio for interaction [3]
02 The Second Case案例二
看完Roche/Genentech公司的案例之后,接下来看一下Bristol Myers Squibb的案例。BMS用于识别CPP的实际显著性的参数命名为Impact factor,该数值的计算公式和实际应用如下图所示:
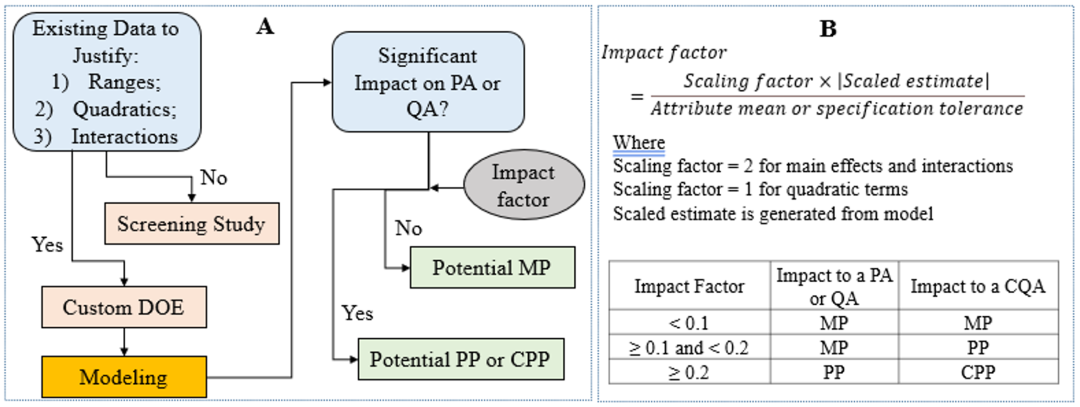
Fig.5 Role of DOE study to determine IPC strategy[4]
与Roche/Genentech公司的Impact ratio相似,Impact factor也是一个分数,分子为DoE实验中参数对于CQA的影响,其中Scaled estimate为DoE实验中通过统计学分析得到的参数估计值;而分母为CQA的specification tolerance(Attribute mean用于工艺表现相关属性),当对于CQA的Impact factor ≥ 0.2时,该参数就被认为是CPP。
整体来看,BMS的方法和Roche/Genentech公司基本一致,不同之处在于在这个公式中考虑到了主效应、交互作用和二次项的影响。针对specification tolerance的算法,文章中并没有提及,但是从名字中可以看出,肯定是与质量标准相关的,和IR的计算没有太大的差异。在文章中,也有Impact factor和Scaled estimate的数值,想要知道specification tolerance数值的读者也可以自己反推一下。
03 The Third Case案例三
最后是Lilly公司的案例,Lilly在2014年发表了一篇非常完整详实的细胞培养工艺的表征研究,在CPP识别的过程中,Lily同样结合了DoE研究的数据以及临床样品生产的经验,从统计显著性和实际显著性两个维度进行了分析来识别参数的分类。工艺参数识别的决策树如下图所示:
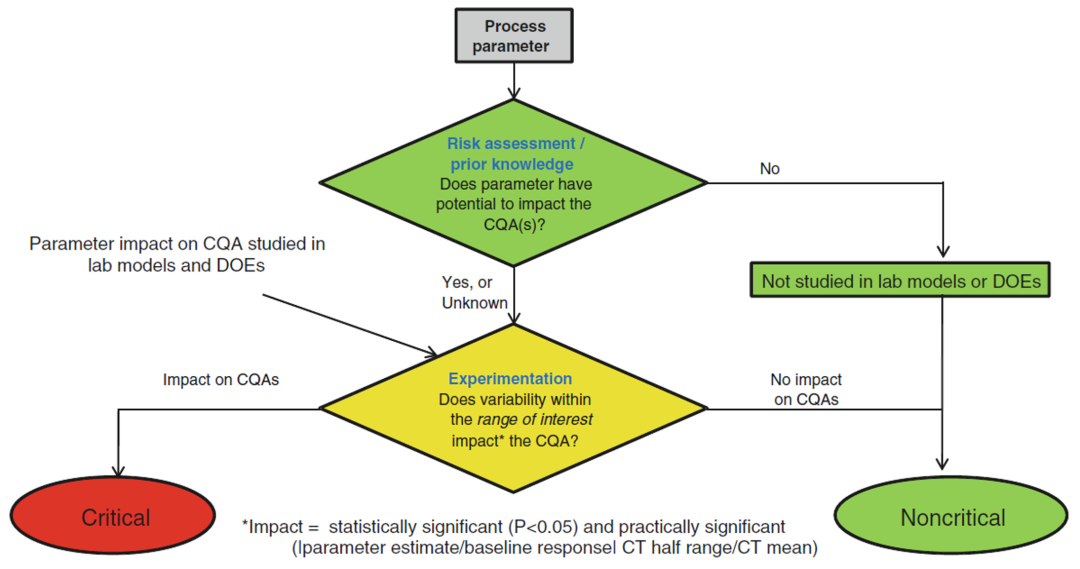
Fig.6 Logic diagram used to facilitate the classification of process parameters as critical or not critical [5]
从图中可以看到,参数如果对于CQA有影响,就认为该参数为关键参数。那什么叫做有影响呢?就是既在DoE实验的数据分析中,工艺参数对于CQA有显著的影响(即p<0.05),同时进行实际显著性的评估,参数也具有实际显著性的话,那就认为这个参数对于CQA有影响,会被识别为CPP。工艺参数影响是否具有实际显著性则由下面这个公式来确定。

同Roche/Genentech和BMS的方法不同,Lilly的实际显著性并不是通过一个计算公式然后设定一个数字化的标准来进行判断,而是直接比较工艺表征实验中得到的参数对于CQA影响的程度和临床样品生产(CT)阶段产品CQA的变异性。Parameter Estimate是DoE实验中通过统计学分析得到的参数估计值,Baseline Response在文中没有明确说明,我理解为工艺表征过程中的对照工艺下得到的CQA的平均值。CT Half Range指的是临床样品生产阶段产品CQA的变化范围的一半,CT Mean指的是临床样品生产阶段产品CQA的平均值。可以看到,Lilly将临床样品生产阶段的产品CQA的可变性用作比较的基准,因为这个数据可能是对于工艺固有可变性的一个实际体现,如果我们参数对于CQA影响的变异性小于工艺固有的变异性,那就可以认为工艺参数的变化对于产品CQA没有实际的影响。
综合来看以上几个公司的实际显著性策略会发现,实际显著性计算的方式、判断的标准以及实际的应用均存在一定的差异。虽然存在着许多差异,但是业界对于CPP识别过程中需要采用实际显著性这一趋势是没有太多质疑的。这主要是因为实际显著性在合理地减少CPP数量上确实能够起到立竿见影的效果,这样也有助于我们把有限的精力投入到对于质量影响更大的CPP的控制之中,从而更好地在商业化生产过程中控制产品的质量。
康日百奥生物科技(苏州)有限公司作为一站式生物药CDMO服务商,提供从细胞株构建、细胞培养工艺开发、分析方法开发、制剂处方工艺开发、纯化工艺开发、工艺表征、工艺验证以及原液和成品的cGMP生产。康日百奥致力于为合作伙伴提供高质量,高效率的生物药开发生产服务。在工艺表征阶段,我们建立完整的方法流程,基于工艺参数的风险评估、缩小模型的建立和确认、工艺表征实验、控制策略的建立、和风险评估更新等一系列工艺表征步骤,制定了完整的工艺控制策略,并可应用到商业化生产过程中。通过风险评估确定CQA以及CPP、缩小模型的建立、DoE实验设计、可比性分析、最差条件确认,进而确认关键工艺参数的设计空间,最终建立工艺控制策略。康日百奥搭建有完整的工艺表征技术平台,针对市场主流的商业化规模反应器系统建立了相应的缩小模型,可针对影响产品关键质量属性的中高风险参数进行多变量实验设计,基于关键质量属性的识别,为商业化规模生产工艺参数确定了科学合理的参数范围,用于支持后续的工艺验证环节和药品上市申报。同时,根据不同合作伙伴项目的独特性,制定相应的技术转移、工艺开发、工艺表征及放大生产方案。

康日百奥作为一家专业的生物药CDMO服务供应商,拥有强大的工艺开发团队,在工艺表征和工艺验证的项目上都拥有丰富的知识积累及充足的实战经验,保证客户项目的顺利交付。团队成员已经帮助多家国内外知名公司成功转移、放大和生产2000 L的临床和商业化产品,同时具有丰富的药品申报上市经验,其中包含多批具有较高技术难度,从3 L直接放大至2000 L的生产项目,成功率100%。
参考文献
1. Christian Hakemeyer, et al, Process Characterization and Design Space Definition. Biologicals 44 (2016) 306-318
2. Sarah Demmon, et al, A Cross-industry Forum on Benchmarking Britical Quality Attribute Identification and Linkage to Process Characterization Studies. Biologicals 67 (2020) 9-20
3. Jens Lamerz, et al, An Improved Impact Ratio for Identifying Critical Process Parameters in Pharmaceutical Manufacturing Processes. PDA Journal of Pharmaceutical Science and Technology 2022
4. Jianlin Xu, et al, Upstream Cell Culture Process Characterization and In-process Control Strategy Development at Pandemic Speed. mAbs 14(2022)
5. Daniel M. Marasco, et al, Development and Characterization of a Cell Culture Manufacturing Process Using Quality by Design (QbD) Principles. Advances in Biochemical Engineering/Biotechnology, 2013
















